Pengertian, Manfaat, & Macam-Macam Hidrolisis - Sejarah
jonygoblog.blogspot.com - Baiklah sobat, pd artikel ni kita akan membahas mengenai Pengertian, Manfaat, dan Macam-macam Hidrolisis, langsung saja kita masuk ke pembahasannya.
PENGERTIAN HIDROLISIS
Jika suatu molekul asam direaksikan dgn molekul basa maka akan membentuk garam dan air. Reaksi ni disebut sebagai reaksi penetralan. Namun, pd dasarnya larutan garam tersebut tak selalu bersifat netral, tetapi dpt jg bersifat asam maupun basa. Untuk menjelaskan sifat larutan garam tersebut digunakanlah konsep hidrolisis. Berikut ni tabel beberapa jenis asam kuat, basa kuat, serta garam dgn komponen asam basa pembentuknya.
 |
| Asam Kuat (Kiri), Basa Kuat (Kanan) |
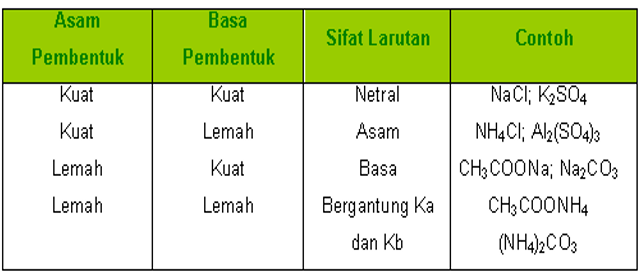 |
| Garam |
Reaksi kimia yg terjadi antara molekul air dan garam, dimana komponen garam (kation / anion) yg terdiri dari asam lemah / basa lemah akan membentuk ion H3O+=(H+) sebagai ion positif dan ion (OH-) sebagai ion negatif. Apabila reksi hidrolisis menghasilkan ion H3O+ maka artinya larutan bersifat asam, tetapi jika reaksi hidrolisis menghasilkan ion OH- maka larutan bersifat basa.
Secara matematis, rumus kimianya dpt ditulis dlm reaksi berikut ini.M+ + H2O à MOH + H+Sedangkan anion bereaksi menjadi:X-+ H2O à HX+ OH- Jadi, dpt disimpulkan bahwa hidrolisis adlh penguraian garam oleh air yg menghasilkan asam dan basanya. Reaksi hidrolisis terjadi ketika beberapa senyawa-senyawa ionik, seperti garam, asam, dan basa tertentu larut dlm air.
Artikel Penunjang : Pengertian, Sifat, dan Teori Asam dan BasaMACAM-MACAM HIDROLISIS
Jika ditinjau dari komponen pembentuk garam serta banyak tidaknya garam tersebut dpt diuraikan ketika direaksikan dgn air, maka reaksi hidrolisis dpt dibedakan sebagai berikut ini.
1. Hidrolisis parsial Hidrolisis parsial ialah ketika garam direaksikan dgn air hanya salah satu/sebagian ion saja yg mengalami reaksi hidrolisis, sedangkan yg lainnya tidak. Komponen penyusun garam yg mengalami reaksi hidrolisi parsial ni ialah asam lemah dan basa kuat / sebaliknya.
2. Hidrolisis total Hidrolisis total merupakan reaksi penguraian seluruh garam oleh air, yg mana komponen garam terdiri dari asam lemah dan basa lemah.
Berdasarkan jenis ion-ion yg dihasilkan ketika garam terlarut dlm air, proses hidrolisis dpt dibedakan menjadi beberapa macam berikut ini.
3. Hidrolisis Anion Apabila garam yg terdiri dari komponen molekul asam lemah dan basa kuat direaksikan dgn molekul air, maka garam-garam ni hanya akan terhidrolisis sebagian/parsial didalam air dan akan menghasilkan ion yg bersifat basa (OH-). Dengan kata lain, yg terhidrolisis adlh sedangkan anion dari asam lemah sedangkan kation dari basa kuat tak terhidrolisis.
Misal: CH3COONa(aq) → CH3COO-(aq) + Na+(aq) CH3COO- + H2O ↔ CH3COOH + OH- Na+ + H2O → tak terjadi reaksi
Dari contoh diatas, menjelaskan bahwa CH3COO- yang bertindaksebagai anion asam lemah terhidrolisis membentuk OH- ketika direaksikan dgn molekul air (H2O) sedangakn Na+ yang bertindak sebagai kation dari basa kuat tak terhidrolisis ketika direkasikan dgn molekul air. Kesimpulannya garam dgn komponen pembentuk asam lemah dan basa kuat, jika direaksikan dgn air akan terhidrolisis sebagian dan menghasilkan ion yg bersifat basa.
4. Hidrolisis Kation Serupa halnya dgn reaksi hidrolisis antara garam dgn komponen molekul asam lemah dan basa kuat direaksikan dgn molekul air, jika garam dgn komponen penyusun asam kuat dan basa lemah dilarutkan ke dlm molekul air jg akan mengalami hidrolisis parsial dan menghasilkan ion yg bersifat asam (H+). Hal ni terjadi karena hanya kation dari basa lemah terhidrolisis, sedangkan anion dari asam kuat tak mengalami hidrolisis.
Misal: NH4Cl → NH4+ + Cl- NH4+ + H2O ↔ NH4OH + H+ Cl- + H2O → tak terjadi reaksi
Berdasarkan contoh diatas, dpt dijelaskan bahwa NH4+ yg bertindak sebagai basa lemah terhidrolisis menghasilkan ion yg bersifat asam, yakni H+. Sedangkan Cl- yg sebagai anion asam kuat tak terhidrolisis.
5. Kation dan Anion Terhidrolisis Apabila garam dgn komponen asam lemah dan basa lemah direaksikan dgn molekul air akan mengalami hidrolisis total. Hal tersebut dpt terjadi dikarenakan kation dari basa lemah maupun anion dari asam lemah dpt terhidrolisis secara sempurna. Reaksi hidrolisis ni menghasilkan ion H+ / OH-.
Misal: CH3COONH4 → CH3COO- + NH4+ CH3COO- + H2O ↔ CH3COOH + OH- NH4+ + H2O ↔ NH4OH + H+
Contoh diatas, menjelaskan bahwa kedua komponen penyusun garam CH3COO- (anion dari asam lemah) dan NH4+ (kation dari basa lemah) dpt terhidrolsis secara sempurna yg masing-masing berurutan menghasilkan ion yg bersifat basa (OH-) dan ion yg bersifat asam (H+).
Perlu untk diketahui, bahwasanya garam dgn komponen asam kuat dan basa kuat yg direaksikan dgn molekul air tak akan mengalami hidrolisis, dlm arti lain reaksi tersebut bersifat netral. Peristiwa ni dpt terjadi ketika garam yg mengandung ion logam alkali / ion logam alkali tanah (kecuali Be2+) dan basa konjugat suatu asamkuat (misalnya, Cl-, Br-, dan NO3-) direaksikan dgn molekul air akan menghasilkan larutan yg bersifat netral.
PEMANFAATAN HIDROLISIS Reaksi hidrolisis merupakan suatu reaksi kimia yg digunakan untk menetralkan suatu campuran asam dan basa yg menghasilkan air dan garam. Proses hidrolisis tersebut memiliki andil yg besar dlm terlaksananya berbagai macam proses penting dan kebutuhan dlm kehidupan sehari-hari.
Berikut ni uraian lebih lanjut terkait beberapa pemanfaatan proses hidrolisis. Reaksi hidrolisis antara molekul asam dan basa yg direaksikan dgn air akan membentuk garam dgn rumus kimia NaCl. NaCl ni merupakan garam yg digunakan di dabur ibu rumah tangga sebagai pemberi rasa asin dlm makanan. Di bidang pertanian, reaksi hidrolisis dimanfaatkan dlm penyesuaian pH tanah dgn tanaman yg ditanam. Melalui reaksi hidrolisis akan didapatkan jenis pupuk yg tak terlalu asam maupun basa. Adapun molekul kimia yg sering digunakan untk menurunkan pH pupuk ialah pelet padat (NH4)2SO4. Apabila garam tersebut direaksikan dlm air, maka ion NH4+ akan terhidrolisis di dlm tanah membentuk NH3 dan H+ yg bersifat asam. Reaksi hidrolisis antara garam yg terbentuk dari HOCl yg merupakan asam lemah dgn NaOH yg merupakan basa kuat dgn air akan terjadinya hidrolisis HOCl sehingga menghasilkan ion OH- yang bersifat basa. Sedangkan NaoH sebgai basa kuat tak terhidrolisis. Garam yg terbentuk melalui penggabungan kedua asam basa terdebut ialah NaOCl. Garam ni merupakan salah satu material yg dimanfaatkan dlm pembuatan bayclin / sunklin untk memutihkan pakaian kita. Reaksi hidrolisis memiliki peran penting dlm pemecahan makanan menjadi nutrisi yg mudah diserap. Sebagian besar senyawa organik dlm makanan tak mudah bereaksi dgn air, sehingga dibutuhkan katalis untk memungkinkan keberlangsungan proses ini. Katalis organik yg membantu dgn reaksi dlm organisme hidup dikenal sebagai enzim. Enzim ni bekerja dgn menerapkan konsep hidrolisis. Reaksi hidrolisis berperan penting dlm proses pelapukan batuan. Proses ni penting dlm pembentukan tanah, dan membuat mineral penting tersedia bagi tanaman. Berbagai mineral silikat, seperti feldspar, mengalami reaksi hidrolisis lambat dgn air, membentuk tanah liat dan lumpur, bersama dgn senyawa larut. Reaksi hidrolisis memiliki andil dlm penjernihan air. Penjernihan air minum oleh PAM menerapkan prinsip hidrolisis, yaitu menggunakan senyawa aluminium fosfat yg mengalami hidrolisis total.
Baca jg : Larutan Elektrolit dan Non-Elektrolit
Jadi, dpt disimpulkan bahwa reaksi hidrolisis terjadi ketika beberapa senyawa ionik, seperti asam, basa, dan garam dilarutkan dlm molekul air dan dpt menghasilkan sifat yg bervariasi baik itu asam, basa, maupun netral. Perbedaan sifat ni menjadi tolok ukur dlm menganalisa peran penting garam yg terhidrolisis tersebut dlm kehidupan makhluk hidup.
Inilah artikel kita kali ni mengenai Pengertian, Manfaat, dan Macam-macam Hidrolisis, semoga bisa menambah ilmu sobat semuanya dan bermanfaat.
other source : http://google.com, http://softilmu.blogspot.com, http://reddit.com



Komentar
Posting Komentar